|
|
●金属の腐食 |
●湿食と乾食
金属が使用環境で化学的あるいは電気化学的反応によって侵食される現象が腐食である。水分が関与する場合を湿食といい、水分が伴わない場合は乾食という、腐食はこの二つに大別される。湿食は水中、地中、あるいは大気中など比較的低温でみられ腐食の大部分をしめる。乾食は高温の空気あるいはガスによる酸化反応で、高温酸化とも呼ばれる。
●腐食の電気化学的機構
水中における金属の腐食は電気化学的反応に基づいて進行する。酸化反応(アノード反応)と同時に還元反応(カソード反応)を伴い.腐食が進行すると金属は金属イオンとなって溶液中に移行し、水素イオンは水素ガスあるいは溶存酸素によって水になる。
アノード:M →Mn++neー
カソード:2H+ +2eー→H2(酸性溶液、水素発生)
O2+4H++4eー →2H2O(酸性溶液、酸素還元)
O2+2H2O+4eー→4OHー(中性またはアルカリ性、酸素還元)
金属が腐食するにはアノードとカソード反応が金属表面で等しい速度で同時に起こる。
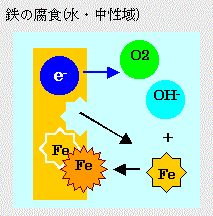
●中性溶液中で鉄が腐食する反応式
アノード: 2Fe→2Fe2++4eー
カソード: O2+2H2O+4eー→4OHー
全反応:2Fe+O2+2H2O→ 2Fe(OH)2
この化合物に酸素および水の供給をうけて2Fe(OH)2+H2O+1/2O2→2Fe(OH)3赤さびとなる。さらに水和酸化鉄(FeOOH)またはFe2O3・nH2Oに変化する。このとき酸素が不足するとFe3O4・nH2O(黒さび)となり、実際の鉄のさびは表面が赤さび下地が黒さびの2層構造となっていることが多い。
●腐食電池
●異種電極電池 異種金属との接触、あるいは同一種類で組成比・組織・結晶方位が異なる等で金属表面において形成される腐食電池。
●濃淡電池 腐食電池の中で最も多くみられる。同一金属が濃度の異なる同種の電解質溶液に別々に浸漬されたときに形成される電池。
1 塩濃淡電池 / 溶液に濃度差があると、希薄溶液に接した箇所で腐食が起こる。
2 通気差電池 / 同一濃度の溶液であっても溶存酸素量に差があると空気を含まない極がアノードとなって電流が溶液中に流出(腐食)する。例えばさびの真下は周辺部より酸素不足となり腐食される。また水面付近は大気からの酸素の供給が多くカソード部となるが、その下部は酸素が少なくアノード部となって腐食する。
金属の合わせ目、ボルトの下、ガスケット面および他の物質の付着面などでみられる隙間腐食(crevice corrosion)は、このような濃淡電池の形成による。酸素の少ない内部がアノードとなって腐食されるが、進行すると金属イオンや水素イオンが蓄積し塩濃度の増加とpHの低下により腐食は一層加速される。
●温度差電池 温度変化によって生じる電位差よる電池。暖部がアノード冷部がカソードとなる。ボイラー、熱交換器、投込みヒーターなどで発生することがある。
●標準電極電位
金属の腐食傾向は腐食電池の起電力の大きさによって表すことができる。一般に標準水素電極を基準に各金属の標準電極電位を大きさの順にならべ電気化学列と言う。負の大きな値を卑あるいは電位が低い(あるいはイオン化傾向が大きい)、正の大きな値を貴あるいは電位が高い(イオン化傾向が小さい)と表現される。金属の基本的な腐食傾向がわかるが、実際の電位は環境と金属の表面状態で異なる。
●異種金属の接触と腐食
電極電位が異なる金属が接触しそれに電解質溶液が存在すると卑な金属が腐食される、異種金属接触腐食あるいはガルバニック腐食(galvanic corrosion)と呼ばれる。接触する金属の電位差が大きい程、さらに卑な金属に対する貴な金属の表面積が相対的に大きい程、影響は大い。
ステンレスと炭素鋼、銅と炭素鋼などの異種金属が接触している場合、いずれも炭素鋼単独の場合よりも腐食が加速される。加速される原因は酸素である、貴な金属がカソード反応の場を提供するので、それに見合ったアノード反応としての溶解が炭素鋼で起こる。
●脱成分腐食
腐食により合金成分の特定元素が選択的に溶出する現象を、脱成分腐食または選択腐食と呼ぶ。このような腐食をうけた金属は、寸法変化は少ないが表面の変色、強度や延性の低下等が著しい。
水道用金具としてよく使われている銅亜鉛合金の真ちゅう腐食では、合金組成の亜鉛が溶出し脱亜鉛腐食と呼ばる。Au−AgおよびAu−Cuのような貴金属合金にも、分金といわれる脱成分腐食がみられ、Auより卑な金属が溶出する。
●銅や亜鉛の腐食
鉄以外の銅管や亜鉛めっき鋼管の腐食も要因は水中の溶存酸素である。銅は貴な金属で、本来、耐食性を有する金属であるが、しばしば温水中で孔食や潰食などのピンホールを生じることがある。孔食は地域や用途によって起こる場合と起こらない場合がありメカニズムはまだ明確になっているとは言えない。潰食は水流速が高い場合に銅管内面に馬蹄形の侵食を起こすがこれも電池作用が主体なのである。水流速が高いと酸化膜を破壊し裸になった銅の表面で電池作用による腐食が増大するのが原因である。 |
| ●機械的な腐食促進 |
●応力腐食割れ
引張り応力、残留応力が存在する金属材料が、その応力が材料の引張り強さ以下であっても腐食を伴って破壊されることがある。応力腐食割れと呼ばれる。応力腐食割れは電気化学的腐食と応力による機械的な破壊が交互に加って進行する。
●腐食疲労
腐食疲労は金属材料が腐食性の環境下で、引張り応力を繰返し、または交番応力を頻繁に受けた場合に生じる割れである。応力腐食割れの一種とも考えられている。
●水素脆性
酸洗やめっき工程を経た部品の折損、あるいは使用中の高張力鋼ボルトが僅かな腐食を伴って破損することがある。このような現象は水素脆性あるいは遅れ破壊とよばれ、硬さの高い鋼、油井鋼管のように弱酸性の硫化物を含む雰囲気などでも見られる。これらは工程中に金属材料に侵入した水素、あるいは腐食でカソード領域で発生した水素が原因となっていることが多く、割れは主として結晶粒内でおこる。
●腐食摩耗
腐食摩耗はエロージョン・コロージョンともいわれ、流動する液体中で発生する腐食損傷で、熱交換器の復水管などでみられ流動液体により金属表面の保護被膜が物理的に取除かれて進行する。
キャビテーション・エロージョンとよばれている腐食は、ポンプローターやプロペラの背面、比較的流れの速い配管内など流速が急激に変化する箇所で発生する。
●擦過腐食
擦過腐食は、一方または両方が金属の接触面部で、ごくわずかな相対的運動で生じるすべりが存在する箇所でみられ、腐食生成物の大部分が金属酸化物であるのも特徴である。この腐食は、生じた酸化物および金属摩耗粉により促進される。軸受、振動機械、電気リレーの接点等にみられる。 |
| ●防食方法 |
防食方法は環境処理、環境遮断、材料の選択、電気防食の四つに大別できる。耐食性、コストなどを考慮して使用条件に適合した防食方法を選択する。
●環境処理
電気製品や金属製品の輸送あるいは保管中の変色・腐食対策には、防湿包装材料を用いて、腐食要因の酸素と水分の透過量をコントロールする。また、ボイラー、プラントや自動車のラジエーターの冷却水には、水質管理の徹底、脱酸素あるいは腐食抑制剤(インヒビター)の添加による腐食の軽減が行われている。
●環境遮断
各種金属のめっきや金属溶射のような金属被覆、塗装、アルミニウムの陽極酸化(アルマイト)、りん酸塩処理、ほうろう質又はガラス質による非金属被覆がある。
●耐食材料
金属材料の耐食性は使用環境によって変わるので、材料選定は種々の金属の実用事例などを参考にして行われている。材料の決定には、耐食性のほか、加工性、強度、入手の容易さ、および価格なども考慮される。
●電気防食
原理は電位−pH図で説明される自然腐食状態にある金属の電位を、不感域に移行させるの陰極防食と、不動態域に移行させる陽極防食がある。pHによっても不動態域に移行できる。電気防食は水中や土中の装置や施設に広く採用され、金属の電位を電流により変化させて腐食を防止する。 |
●カソード防食法
●pHによる防食
pHの低下とともに水素イオン濃度は増加し、水素発生型のカソード反応速度も大きくなる。従って酸性雰囲気は防食に好ましくない。中性溶液でも局所的にpHが下がり局部腐食を生じることがある。
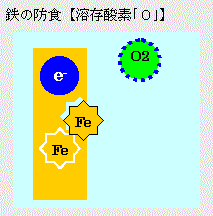
●溶存酸素量による防食
酸素消費型のカソード反応は、溶液中の溶存酸素の還元反応が主反応となる。この反応を抑制するには、酸素濃度の低減、酸素拡散の抑制方法が考えられる。前者は科学的薬品により溶存酸素を除去する方法や、煮沸する(温度が上がると酸素溶解量が減少する)方法、後者では溶液の流速を抑え酸素の拡散を防止する等がある。
●アノード防食法
●電位による防食
ガルバニック腐食では、腐食を防止したい材料の電位を貴に設定する必要がある。小さな電位の差でも相手材との面積比によっては大きな腐食電流が流れることがある。電位を貴な方へシフトする方法に合金化がある。
●不働態被膜形成による防食
金属の溶解過程で貴金属のような特性を示すような現象がある。金属が表面に酸化物、水酸化物等の被膜を形成し、表面からの溶解を阻止するような現象で不働態と呼ばれ、この被膜は不働態被膜と呼ばれる。鉄鋼材では鋼にNi、Cr等を添加したステンレス鋼として知られている、超硬合金では結合相金属をCoからNiにしたり、さらに酸化膜を作りやすいCr、Moを添加する方法や、結合相をTiとする方法等がとられている。
●その他の防食法
焼結硬質材では表面にポアや欠陥があると隙間腐食が生る。カソード・アノード両反応を防止するために表面を完全に被覆してしまうコーティング処理等がある。
●腐食電池
電解質(イオンを含んだ溶液)の中に2種類の金属を入れて間を導線で結ぶ。例えば亜鉛と銅とすれば、銅がプラス、亜鉛がマイナスの電極となる。銅から亜鉛の方へ電流が流れ、電流は逆方向への電子の流れですから、亜鉛電極で電子が発生し、銅電極で電子が消費されることになる。亜鉛原子は金属の中に電子を残して、亜鉛イオンとなって電解質の中に溶出する。亜鉛イオンは電解質の中の水素イオンと入れ替わり、水素イオンは銅の方へ動いて電子と結合して水素ガスを発生させる。
この一連の反応は同時に起こり、もし導線を外すと止ってしまう。この反応が継続するには電流を流す回路が構成されなければならない。
この反応の中心は亜鉛が溶けてイオンに変わっていくことで、金属の腐食とは電池が構成される反応が起こって金属の表面がイオン化して溶出することである。このとき腐食するのは必ずマイナス極側の金属であり、もう一方の金属では腐食は起らない。このような電池を腐食電池という。
腐食電池が作られるためには、次の2要素が必要である。
●電解質があること
●2種類の金属があって電気的に接続している部分があること
普通の水でもわずかに不純物が含まれていれば電解質であるといえる。一種類の金属でも僅かな不均一や不純物で、ある部分がプラス極・マイナス極となってミクロの腐食電池となる。このミクロな腐食電池によってある部分の原子が溶出すると、次に別の部分が新たな腐食電池となる繰返しで腐食が進行する。 |
| ●鉄の腐食と酸素 |
腐食電池ではマイナス極とプラス極で同時に反応が起こる。マイナス極では金属が溶けてイオンになる酸化反応、プラス極では金属から電子を受け取る還元反応である。この反応を起こす物質は、鉄の場合では水素イオンと水中に溶けている酸素である。
水が酸性の時は水素イオンが多数あるので、鉄が水素を発生させながら腐食することになる。
水が中性の時は水素イオンの量が少ないので、水に溶けている酸素(溶存酸素)が反応の主体となる。腐食電池のマイナス極で鉄イオンが作られ、プラス極で溶存酸素と水から水酸基が作られ、この二つが反応して酸化鉄となる。このように溶存酸素量が腐食の進行に大きく関与し、溶存酸素量は小さいが外部(空気中)から酸素が供給され続けることで腐食が進行する。
鉄だけで他の金属と接していない場合でも、部分的に酸素の供給量に差があると腐食電池を構成することになる。例えば水の中に鉄を入れて、その一部が空気中に露出している場合は水面のすぐ下で腐食が進行し、通気差腐食と呼ぶ。
●不動態
金属の中には腐食しやすいものとそうでないものがあり、その度合いを知る一つの尺度にイオン化傾向がある。一般にはイオン化傾向の大きいものほど腐食しやすいが、Al、Ni、Ti、Crなどの例外もある。
これらの金属では酸素との反応度が大きく、金属の表面が空気に触れたわずかの時間で酸化してしまう。このときにできる酸化膜は非常に薄く、均一で金属の光沢は元のままです。この膜ができることによって、その内部は外気と遮断され、腐食しなくなる。この被膜を不動態被膜といい、不動態被膜をもっている状態を不動態化するという。
これらの金属が不動態化するかどうかは、環境条件によって決まる。中性の水の中では不動態化しても、塩酸や稀硫酸などによって不動態被膜が溶けてしまう場合がある。アルカリ性環境では大抵の不動態被膜は安定だが、アルミニウムなどは腐食が進行する。ステンレス鋼がさびないのは、多量に含まれるクロムによって不動態化するからである。
●腐食抑制剤
腐食抑制剤としては、リン酸塩系、シリケート系、アミン系、高分子系、オキソ酸塩(モリブデン酸塩、亜硝酸など)など種々実用されている。添加する場合、地球環境にできるだけやさしい防食剤が求められている。クロム酸イオンは有用な防食剤であるが近年使用が減っている。腐食抑制剤が腐食を抑制する機構は三つに大別できる。
●不動態化を促進する添加剤=不動態化剤、不動態化剤には常に局部腐食の不安がつきまとう
●表面に酸化物以外の被膜をつくるなどして金属の溶出を抑制する場合=アノードインヒビター
●金属の溶出と対になって生じるカソード反応を抑制する場合=カソードインヒビター |
●異種金属接触腐食・ガルバニック腐食・局部電流腐食
galvanic corrosion / contact corrosion / bimetallic corrosion |
種類の異なる金属を接触させ電解質溶液中に浸漬すると、両者の標準電極電位が異なるため、イオン化傾向の大きい金属(卑な金属)と小さい金属(貴な金属)間に電位差が生じ電池(局部電池、ガルバニ電池)が形成され電流が流れ(局部電流)腐食が生じる。このような異なる金属を電極とした、局部電池の形成による電気化学的反応で生じる腐食を異種金属接触腐食・ガルバニック腐食・局部電流腐食と呼ぶ。
電流は接触部では貴な金属から卑な金属へ流れ、溶液中では卑な金属から貴な金属へ逆に流れる。その結果、卑な金属は金属イオンとなり溶液中に溶解し腐食が促進される。またな金属は、金属イオンとなり溶液中へ溶け出すと同時に、電子が貴な金属へ移動する。外部へ電子を供給する電極を陽極(アノード)、外部から電子を受け取る電極を陰極(カソード)と呼ぶ。
電位の低い金属(イオン化傾向の高い金属)が陽極に、電位の高い金属(イオン化傾向の低い金属)が陰極に相当する。両者の関係から、電位差が大きいほど、電流が増大するほど腐食も促進されることになる。
●例えば、硬質材料である超硬合金(WC-Co合金)とステンレス(SUS316)を酸性溶液中で接触させた場合、腐食速度は電子の移動速度すなわち電流値の大小であり、それを決めるのは両者の標準電極電位の差である。標準電極電位差は単独腐食の局部電池機構における電位差より大きく、電子の移動速度が速くなり腐食速度が増加する。WC-Co合金中のCoが優先的に腐食する。
●炭素鋼と黄銅では炭素鋼単独の場合より接触した炭素鋼の腐食は増大し、黄銅の面積が広いほど炭素鋼の腐食は増大する。
●鉄と鉄のような同種金属でもその組織・表面状態の相違などで、電位差があれば異種金属接触腐食が発生する。
●陽極となる金属の腐食の速さは面積比によっても異なる。例えば、普通鋼板にステンレス鋼のくぎを用いた時、普通鋼板の腐食が増すことはないが、ステンレス鋼板に普通鋼のくぎを用いた場合にはくぎはたちまち腐食してしまう。一般的な関係は以下のようなものである。
P=P0(1+B/A)
P:貴な金属に接触後の卑な金属の腐食速度 P0:卑な金属の単独での腐食速度
A:卑な金属の表面積 B:貴な金属の表面積
●金属組織の違いによる腐食
合金のほとんどがミクロ的に見ると均一ではなく、部分的に組成の違いがあるのが通常である。鋳造後、均一な固溶体が形成されれば問題はないが、凝固した組成の中に著しく濃度の異る相が形成されると、それぞれ相がミクロ的に接触した状態となり、相間で電池を形成され腐食され易くなる。
卑金属を主体とした相(固溶体)が陽極となり、貴金属を全体とした相が陰極の状態となって卑金属を主体とした相金属イオンが溶液中へ溶解する。鋳造後、熱処理により組織を均一化処理することでこれらによる腐食を防ぐ方法もある。
|
 |